思春期のスリムシェイプは油断できない

不思議なことに思春期に痩せていると、中年太りする際に、思春期に太っていた人よりも内臓脂肪が沢山つく傾向にある。[1]
中年の人で身体は痩せているのにお腹だけぽっこり出ている人は結構いるだろう。
思春期に太っていた人は全身にまんべんなく脂肪が付きやすい傾向にあるといえる。
・体脂肪率、内臓脂肪
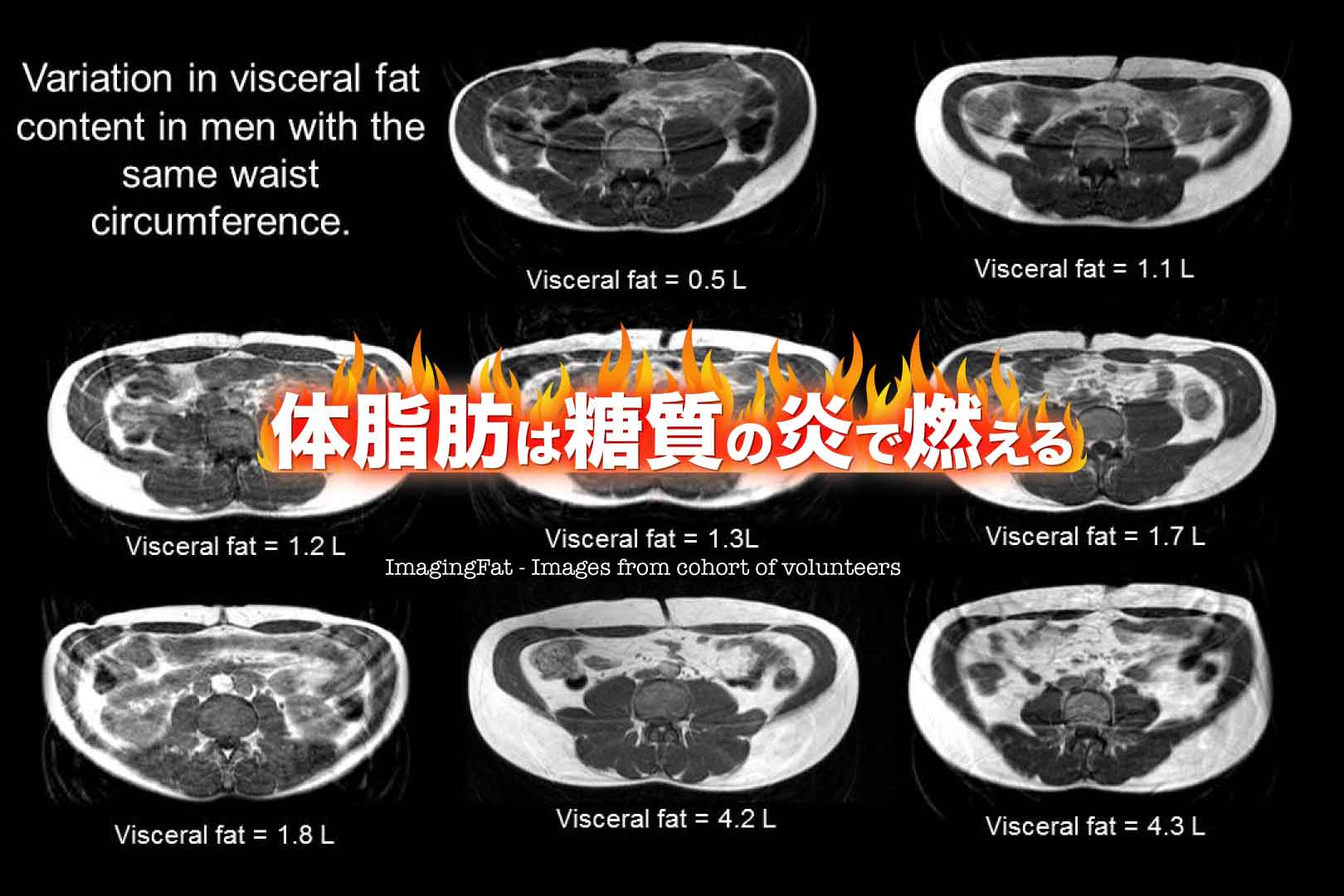
皮下脂肪と内臓脂肪の量を比べた場合、体脂肪率が同じ人でも内臓脂肪が多い人のほうが二型糖尿病のリスクが高くなる。[2]
・体脂肪率、内臓脂肪、リンゴ型
もっとも、脚やお尻よりも、お腹周りに沢山脂肪が付くリンゴ型の太り方は、内臓脂肪の増加でも皮下脂肪の増加でも耐糖能異常のリスクとなる。[3]
・体脂肪率、内臓脂肪、リンゴ型、肝脂肪
敢えてさらに突き詰めるとインスリン感受性の低下は肝臓内の中性脂肪の増加に最も関連が深く、内臓脂肪の増加は脂肪肝傾向のサインであるという示唆もある。[4]
日本人の痩せた女性
糖尿病のリスクが上がるということはいわゆるメタボ症候群として列挙される特徴やそれに関連する「成人病」のリスクが上がると考えておおよそ間違いない。
つまり思春期に痩せ型だった人は内臓脂肪が付きやすいため、あまり太っていなくても糖代謝能力の低下リスクがあるということだ。
このことは例えば、日本人の痩せた女性は標準体重者に比べて耐糖能異常の割合が顕著に高いということに関連してくる。[5]
しかもその割合は米国の肥満者よりもはるかに高い。
内臓脂肪が耐糖能異常をもたらす理由
内臓脂肪の増加が耐糖能異常に関連する理由は内臓脂肪がうまく増殖出来ないからである。[6]
皮下脂肪組織では、脂肪細胞のもとになる細胞(前駆脂肪細胞)が増殖しやすく、細胞数の増加(過形成)を容易にしている。
皮下脂肪の脂肪細胞は小型のまま数が増えるが、内臓脂肪の脂肪細胞は増殖出来ず肥大して炎症をもたらす傾向がある。
この分化能力の違いが炎症性の違いとなっている。
図:脂肪細胞の過形成と肥大・違いと特徴 [9]

左:過形成で脂肪細胞数が増加すると、アディポネクチンの増加、脂肪酸放出の減少、炎症性サイトカインの低下、免疫細胞の動員低下、低酸素症や線維化の低減、インスリン感受性の改善など、有益な傾向がある。
右:脂肪細胞の膨張は、脂肪酸の放出増加、炎症性サイトカイン増加、免疫細胞の動員、低酸素や線維化の増加、アディポネクチンの減少、インスリン感受性の低下など、有害な傾向となる。
思春期の痩せ型が耐糖能異常リスクになるからくり
では何故、思春期に痩せ型だった人のほうが、思春期に太り気味だった人よりも、中年太りで内臓脂肪の増加リスクが高くなるのだろうか?
それは思春期に脂肪細胞数が増えるからだと言われている。
思春期に太り、皮下脂肪細胞が増殖した人は、その後痩せても、ずっと痩せ型だった人よりも多くの脂肪細胞を持っている。
そのため中年太りしても皮下脂肪に余剰を蓄えるキャパシティがある。
ところが思春期を痩せ型で過ごした人には皮下脂肪組織にキャパシティが無く、カロリーを摂りすぎると腹部脂肪が増えやすい傾向にある。
日本人に痩せ型の耐糖能異常が多いのは皮下脂肪のキャパシティが少ないから、というイメージだ。
若い頃から痩せ型で健康状態を保ってきた人が中年になってよりお腹が出やすく、メタボになりやすいというのはなんとも皮肉な話である。
いずれにせよ中年になって腹部脂肪を増やさないようにするしかない。
それには適切な食事と運動を含む活動的なライフスタイル維持が必要不可欠である。
リンゴ型、洋ナシ型、バナナ型

リンゴ型、洋ナシ型、バナナ型の太り方をわずか3個の遺伝子多型(β3AR、UCP1、β2AR)との相関で語った「占い的なダイエット法」を目にすることがある。
特にβ3ARは褐色脂肪細胞でのエネルギー消費に関連するため数十年前から相関に関する研究がいくつも行われたが、今となっては違う角度からの知見が無い限り話題に上ることは無い。
ごく最近のメタ解析でも正の相関は認められているが影響は案の定とても小さい。[7]
それより、環境中の化学物質(農薬)、クロルピリホスが褐色脂肪細胞でのエネルギー代謝を阻害して肥満を誘発することは動物研究で確認されており危惧される。[8]
遺伝子系はさておき「自分はどのような太り方をするか」を知るようにしよう。
サンディエゴ大学・驚きの発見 [10]

ご存知の通りグルコースは肝臓や骨格筋の細胞にグリコーゲンとして蓄えられている。
エネルギーが急に必要になる場合や血糖値の維持のためグリコーゲンが枯渇することはまず無い。
一般にグリコーゲンは骨格筋や肝臓に蓄えられるため、脂肪中のグリコーゲンも単なる備蓄として考えられていた面が大きい。
脂肪細胞の種類と特徴 [11]

今回多くの人が驚いたのは、白色脂肪細胞がベージュ脂肪細胞に変わる契機において、グリコーゲンの代謝が深く関係していることだ。
アドレナリンなどのカテコールアミンによる交感神経系亢進が継続すると脂肪細胞でのエネルギー燃焼が活性化する。
この途中の段階、交感神経系亢進の段階で脂肪細胞におけるグリコーゲンの合成と消費が活発化するのだ。
グリコーゲン代謝の活発化はエネルギーに不足は無いので「アンカップリング」すべし、というGOサインになるという。
アンカップリングとはエネルギー源からATPを造らず、熱に変えてしまうことで余剰を消費する現象である。
研究者らはグリコーゲンを十分に蓄えている脂肪細胞だけがエネルギーを消費するような制御がはたらいているという。
私は「体脂肪は糖質の炎で燃える」というフレーズが好きだが、まさに「体脂肪はグリコーゲンの炎で燃える」という、諺そのままの機序が発見された。
もちろん炭水化物と体脂肪は手を取り合って燃えるという感覚はアスリートの多くは経験的に知っていた。
やはり「ダイエットは糖代謝能力に始まり、糖代謝能力に終わる」と総括するのがふさわしいようだ。
出典:Reference
1. Koda, M., I. Kitamura, T. Okura, R. Otsuka, F. Ando, and H. Shimokata. "Men who were thin during early adulthood exhibited greater weight gain‐associated visceral fat accumulation in a study of middle‐aged Japanese men." Obesity Science & Practice 4, no. 3 (2018): 289-295.
2. Kahn, Steven E., Ronald L. Prigeon, Robert S. Schwartz, Wilfred Y. Fujimoto, Robert H. Knopp, John D. Brunzell, and Daniel Porte Jr. "Obesity, body fat distribution, insulin sensitivity and islet β-cell function as explanations for metabolic diversity." The Journal of nutrition 131, no. 2 (2001): 354S-360S.
3. Goodpaster, Bret H., F. Leland Thaete, Jean-Aimé Simoneau, and David E. Kelley. "Subcutaneous abdominal fat and thigh muscle composition predict insulin sensitivity independently of visceral fat." Diabetes 46, no. 10 (1997): 1579-1585.
4. Fabbrini, Elisa, Faidon Magkos, B. Selma Mohammed, Terri Pietka, Nada A. Abumrad, Bruce W. Patterson, Adewole Okunade, and Samuel Klein. "Intrahepatic fat, not visceral fat, is linked with metabolic complications of obesity." Proceedings of the National Academy of Sciences 106, no. 36 (2009): 15430-15435.
5. Sato, Motonori, Yoshifumi Tamura, Takashi Nakagata, Yuki Someya, Hideyoshi Kaga, Nozomu Yamasaki, Mai Kiya et al. "Prevalence and features of impaired glucose tolerance in young underweight Japanese women." The Journal of Clinical Endocrinology & Metabolism 106, no. 5 (2021): e2053-e2062.
6. Bilal, Muhammad, Allah Nawaz, Tomonobu Kado, Muhammad Rahil Aslam, Yoshiko Igarashi, Ayumi Nishimura, Yoshiyuki Watanabe et al. "Fate of adipocyte progenitors during adipogenesis in mice fed a high-fat diet." Molecular metabolism 54 (2021): 101328.
7. Wang, Hai-Dan, Cai-Shun Zhang, Man-Wen Li, Qian Lin, Qing Zhang, De-Feng Liu, Zheng-Ye Ma, and Jing Dong. "The Association of Trp64Arg Polymorphism in the Beta-Adrenergic Receptor With Insulin Resistance: Meta-Analysis." Frontiers in Endocrinology (2021): 997.
8. Wang, Bo, Evangelia E. Tsakiridis, Shuman Zhang, Andrea Llanos, Eric M. Desjardins, Julian M. Yabut, Alexander E. Green et al. "The pesticide chlorpyrifos promotes obesity by inhibiting diet-induced thermogenesis in brown adipose tissue." Nature communications 12, no. 1 (2021): 1-12.
9. Choe, Sung Sik, Jin Young Huh, In Jae Hwang, Jong In Kim, and Jae Bum Kim. "Adipose tissue remodeling: its role in energy metabolism and metabolic disorders." Frontiers in endocrinology 7 (2016): 30.
10. Keinan, O., Valentine, J.M., Xiao, H. et al. Glycogen metabolism links glucose homeostasis to thermogenesis in adipocytes. Nature (2021). https://doi.org/10.1038/s41586-021-04019-8
11. Lee, Min-Kyeong, Bonggi Lee, and Choon Young Kim. "Natural Extracts That Stimulate Adipocyte Browning and Their Underlying Mechanisms." Antioxidants 10, no. 2 (2021): 308.